Atommassa kontra atomnummer
Innehåll
- Innehåll: Skillnad mellan Atomic Mass och Atomic Number
- Vad är Atomic Mass?
- Vad är atomnummer?
- Viktiga skillnader
Atommassa och atomtal är de två termer som används allmänt i begreppen kemi och fysik. För att förstå vetenskapens nyckelbegrepp har båda dessa termer den betydande betydelsen. De flesta gånger dessa två termer är förvirrande för folket, de utbyter båda dessa villkor. Men de är exakt väldigt unika från varandra även om båda dessa termer har vissa likheter men de skiljer sig från varandra. Egenskaper och egenskaper hos olika material, ämnen och element kan inte förstås genom att förstå betydelsen av dessa termer. Atomnummer används för att tydligt definiera vilken typ av element ett material eller kanske är ett ämne. Det definieras och beskrivs som antalet protoner som finns i ett elementets källa, medan å andra sidan Atommassan definitivt är antalet som är associerat med både protonerna och även neutroner som finns i den speciella kärnan som är associerad med elementet. Elektroner väger verkligen inte väsentligt, därför bestäms atommassan faktiskt med tillsatsen av mängden associerad med protoner till neutroner. Dessutom är det känt som atomvikten.

Innehåll: Skillnad mellan Atomic Mass och Atomic Number
- Vad är Atomic Mass?
- Vad är atomnummer?
- Viktiga skillnader
- Förklaring av video
Vad är Atomic Mass?
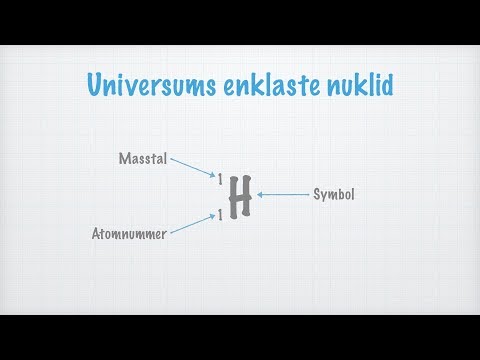
Massnumret eller känt som atommassantal betecknas med (A) vanligtvis skriven på elementets övre sida, det kallas också atommassantal eller kanske nukleonantal, är definitivt den slutliga mängden som involverar protoner och neutroner (som kollektivt benämnda nukleoner) i en atomkärna. Det bestämmer atomens speciella atommassa. På grund av faktumet protoner och även neutroner båda av dem är baryoner, är det specifika massantalet A lika med baryonantalet B eftersom hela atomens kärna eller till och med jon. Massantalet är helt annorlunda för varje distinkt isotop av den kemiska substanskomponenten. Detta är helt enkelt inte detsamma som atomnumret (Z). Massnumret visas ibland efter elementets namn eller kanske som ett superskript till vänster om ditt elements symbol. Till exempel är den mest typiska isotopen som involverar kol definitivt kol-12 eller 12C, som inkluderar 6 protoner såväl som 6 neutroner. Det fullständiga isotopmärket skulle säkert också ha atomnumret. Massantalet bör inte förväxlas med en annan liknande term som den relativa atommassan för ett element.
Vad är atomnummer?
Atomnumret betecknas med ”Z”. När det gäller kemi och fysik är det atomantal som är associerat med ett kemiskt element (även kallad protonnumret) definitivt antalet protoner som är perfekt belägna i kärnan associerad med en atom i det elementet, och av det skälet liknande laddningsnumret för den specifika kärnan. Det är verkligen traditionellt symboliserat med bilden Z. Atomenumret bestämmer uteslutande ett kemiskt element. Inom en oladdad atom är det specifika atomnumret också jämförbart med antalet elektroner. Atomtalet, Z, måste stoppa felaktigt identifierat som massantalet, A, som är antalet nukleoner, mängden neutroner, N, känns igen som neutronnumret associerat med atomen; därför A = Z + N (alla dessa belopp kommer alltid att vara hela siffror). Eftersom protoner och även neutroner har ungefär samma massa (liksom massan hos elektronerna är definitivt försumbar för många ändamål) och även massproblemet som involverar nukleonbindning är vanligtvis mindre jämfört med den specifika nukleonmassan, Atomen, när det indikeras inuti enstaka atommassaenheter Atomer med exakt samma atomnummer Z, men distinkta neutronnummer N, och därför distinkta atommassor, klassificeras som isotoper.
Viktiga skillnader
- Atomnumret representeras av "Z" medan atommassan representeras av "A".
- Atommassan definierar inte typen av element medan atomnumret definierar typen av element.
- Atommassa används för att visa olika isotoper av samma element medan det inte är fallet för atomnummer.
- Atommassan mäts i atommasseenheten (amu) medan atomantalet bara är ett tal.
- Ett antal elektroner är alltid lika med atomantalet men inte lika med massantalet.
- Om atomantalet är högt indikerar det att atommassan också är hög.